|
文獻解讀丨IF=18.9 腫瘤源性凋亡細胞外囊泡介導的細胞間通訊促進肺腺癌的轉移时间:2024-11-28 作者:多萊泌 阅读 2024年6月,中山大學腫瘤防治中心胸外科和中山大學孫逸仙紀念醫院乳腺腫瘤中心聯合在Bioactive Materials期刊上發表題為《Tumor-derived apoptotic extracellular vesicle-mediated intercellular communication promotes metastasis and stemness of lung adenocarcinoma》的原創性研究,探討了腫瘤來源的凋亡細胞外囊泡(apoEVs)如何調節腫瘤細胞,以及它們在腫瘤轉移和復發中的作用。這項研究揭示了凋亡腫瘤細胞與活腫瘤細胞之間的一種新的細胞間通訊機制,這種機制可能促進了癌癥干細胞樣群體的形成,為肺癌的治療提供了新的視角和潛在的治療靶點。
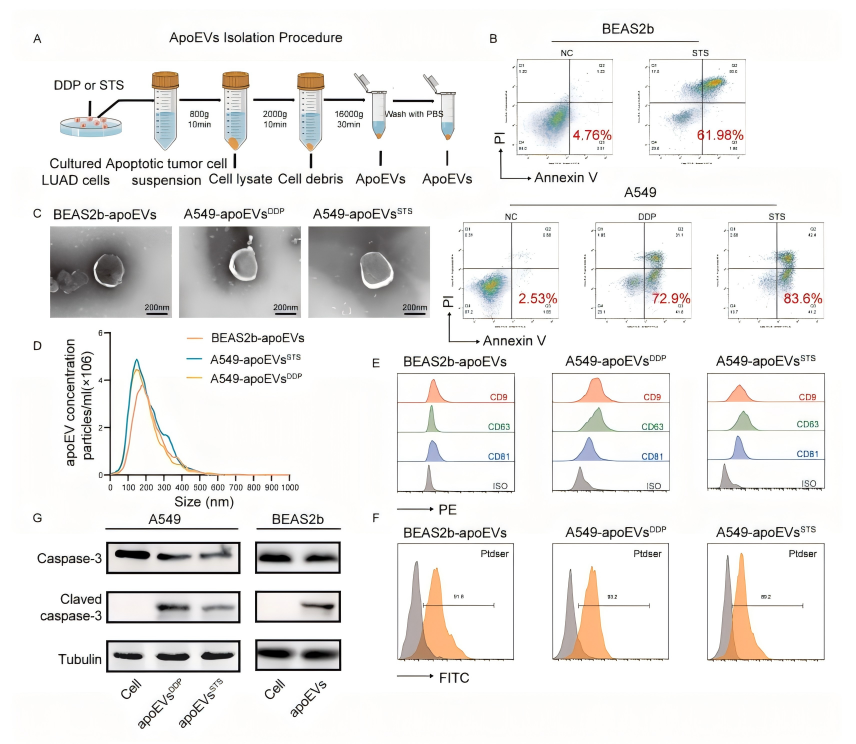
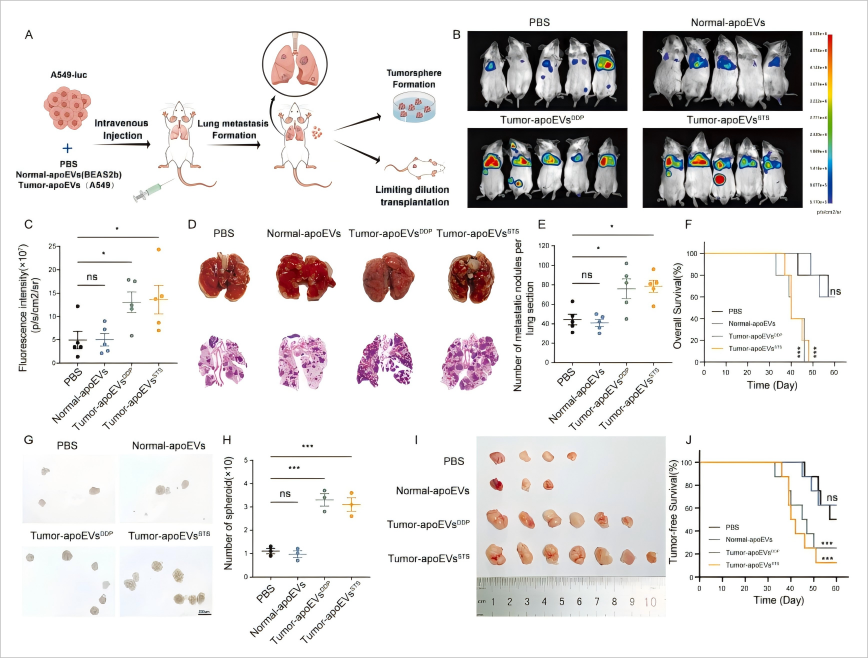
研究背景 肺癌是全球最常見的惡性腫瘤,具有最高的死亡率。肺腺癌(LUAD)是肺癌的主要組織學亞型,占所有肺癌病例的一半以上。盡管采用了多種治療方法,腫瘤復發和轉移仍然是導致腫瘤生長失控和死亡率增加的主要原因。癌癥干細胞(CSCs)的特性可以全面解釋治療失敗的原因,它們具有自我更新和分化能力,能夠產生多種癌癥亞型。SOX2是一個關鍵的轉錄因子,在CSCs中起著保持干細胞未分化狀態的作用,是I期LUAD不良結果的獨立預測因子。SOX2在調節對EGFR-TKIs的耐受性、促進腫瘤轉移和改變免疫微環境中發揮作用,但其在癌細胞中的表達調控機制尚不清楚。 凋亡細胞外囊泡(apoEVs)是在凋亡過程中產生的,包含核酸、蛋白質和其他代謝物。apoEVs與外泌體在大小、形態、密度、蛋白質組成和特定生物標志物上有所不同,且內容物比外泌體更復雜。腫瘤源性apoEVs在腫瘤微環境中的數量較多,可能介導不同癌細胞群體之間的通信,改變腫瘤異質性并促進癌癥進化。 研究內容 1.使用小鼠模型和LUAD細胞進行了一系列體內外實驗 2.通過尾靜脈注射模型研究apoEVs對活腫瘤細胞的影響 3.通過腫瘤形成實驗和移植實驗評估了apoEVs或PBS處理的A549-luc細胞的腫瘤起始細胞頻率和自我更新能力
研究結論 (一)腫瘤來源的apoEVs(與正常細胞來源的apoEVs相比)顯著增強了腫瘤細胞的自我更新能力、干細胞特性和促進腫瘤轉移的能力 (二)在體外實驗中,腫瘤來源的apoEVs增強了LUAD細胞的侵襲、遷移、化療抗性和干細胞特性 (三)通過RNA測序和蛋白質組學分析,發現apoEVs顯著影響腫瘤轉錄組,并富含ALDH1A1蛋白 (四)腫瘤來源的apoEVs通過ALDH1A1/NF-κB/SOX2信號通路促進LUAD的轉移和干細胞特性,為開發新的治療策略提供了依據
文章信息 He X, Ma Y, Wen Y, Zhang R, Zhao D, Wang G, Wang W, Huang Z, Guo G, Zhang X, Lin H, Zhang L. Tumor-derived apoptotic extracellular vesicle-mediated intercellular communication promotes metastasis and stemness of lung adenocarcinoma. Bioact Mater. 2024 Mar 6;36:238-255. doi: 10.1016/j.bioactmat.2024.02.026. PMID: 38481566; PMCID: PMC10933389.
產品推薦 本文中所涉及的細胞上清中apoEVs提取,本公司也有相對應的外泌體提取產品 產品貨號:DL21082-20T-20ml 產品名稱:外泌體提取試劑盒 (細胞上清,尿液)
產品規格:20T
產品介紹:http://www.hudoi.com/dlm2022/wap_pro/52815588.html(點擊了解詳情) |