|
文獻解讀丨通過凍融脂質體-蛋白質復合物輕松制備脂質體介導的蛋白質遞送系統Easy preparation of a liposome-mediated protein delivery system by freeze–thawing a liposome–protein complex 通過凍融脂質體-蛋白質復合物輕松制備脂質體介導的蛋白質遞送系統
摘要 血液中蛋白質的低穩定性和低細胞膜滲透性,需要合適的載體將蛋白質輸送到細胞中。在這里,我們報道了一種將蛋白質包封到脂質體中進行遞送的簡單一步方法。我們使用帶負電荷的超氧化物歧化酶(SOD)和多陽離子脂質體作為蛋白質和脂質體模型。通過凍融SOD-脂質體復合物(lipolexes)制備脂質體包裹的SOD。凍融過程中,脂質體中固定化SOD的數量顯著增加。令人驚訝的是,將單層脂質體冷凍-解凍產生了多層脂質體,SOD位于脂質層之間。與未凍融的脂質體相比,凍融后細胞內傳遞的SOD量顯著增加。
技術線路 1.凍融脂質體的制備及表征。 2.SOD在凍融脂質體中的固定化和封裝百分比。 3.SOD在脂質體中的定位。 4.細胞的攝取。 5.細胞內定位。 6.小鼠體內成像。
實驗結果 1.1凍融脂質體的制備 SOD是一種帶負電荷的蛋白質(pI = 5.86);因此,我們使用帶正電荷的聚陽離子脂質體來制備脂質體。脂質體采用帶正電荷的聚陽離子脂質:DCP-Deta、DOPE和膽固醇(圖1),摩爾比為1:1:1,尺寸為100 nm。 圖1 1.2質體的表征 水合脂質體作為脂質體封裝的sod的對照,水合脂質體的大小略小,表明水合脂質體中包裹的SOD與內部脂質層結合,然后脂質體大小收縮。
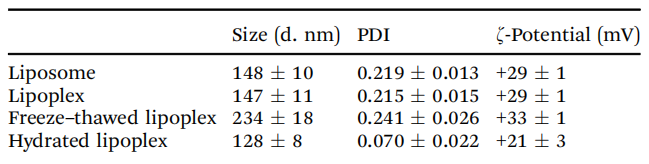
表1脂質體、SOD-脂質體、凍融SOD-脂質體和水合脂質體的粒徑、多分散性指數(PDI)和zeta電位
2.1 SOD在凍融脂質體中的固定化和封裝百分比
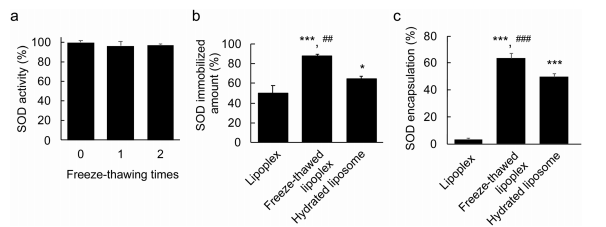
圖2 超氧化物歧化酶(SOD)在凍融脂質體中的固定化和封裝百分比。 (a)SOD的穩定性。將SOD(0.25 mg mL-1)凍融,并測定其活性。這些數據代表了SOD活性與未凍融實驗相比的百分比平均值±標準差(n = 4)。
結論:SOD在凍融處理下是穩定;凍融過程提高了脂質體的固體能力及包封。凍融脂質體是一種有效簡單的封裝蛋白質的脂質體的方法。 3脂質體與SOD的結構定位 用透視電鏡觀察Aunp(金納米顆粒)偶聯SOD制備脂質體。結果表明:可能通過冷凍過程中脂質體膜的破壞,解凍過程中隨后的重組而發生。 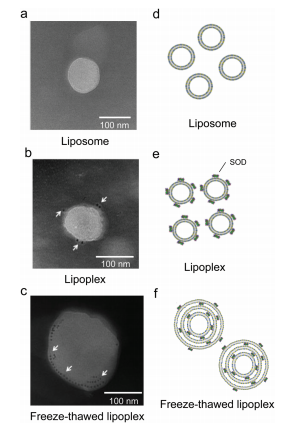 圖3脂質體的結構和超氧化物歧化酶(SOD)的定位。 (a)游離脂質體的(b)脂質體和凍融脂質體樣品的透射電鏡圖像。箭頭表示金納米標記的SOD。比例尺代表100納米。(d-f)脂質體、SOD-脂質體和凍融的脂質體樣品的示意圖。 4細胞攝取
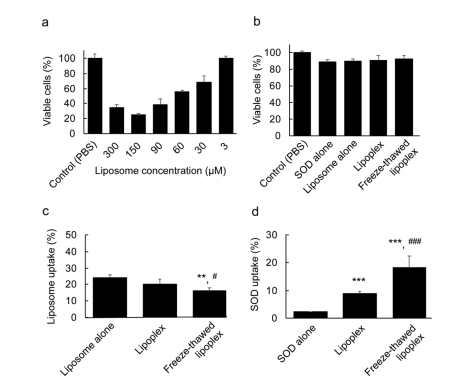
(a)脂質體不同劑量的細胞毒性。將結腸26NL-17細胞與各濃度的脂質體在37℃孵育24 h。然后用WST-8法檢測活細胞。這些數據代表了平均值±標準差(n = 4). (b)每個樣本的細胞毒性。結腸26NL-17細胞分別與cy5-SOD(1 nM)、Dil-脂質體(3 mM)、SOD-脂質體(脂質體3mMSOD1nM)和凍融脂質體(脂質體3mMSOD1nM)在37 1C下孵育24 h。然后,用WST- 8法檢測活細胞。這些數據代表了平均值±標準差(n = 4).(c,d)細胞對脂質體和SOD的攝取。每個樣品都用Dil-脂質體和Cy5-SOD制備。將這些樣品加入到細胞中,孵育24小時。然后,裂解細胞,測定DiI和Cy5-SOD的熒光強度,測定(c)脂質體和(d) SOD攝取率。這些數據代表了平均值±標準差(n = 4).顯著性差異;***p < 0.001與。單獨SOD,**p<0.01與單獨脂質體,###p<0.001,#p0.05與脂質體。 結果:脂質體在濃度為3 mM時,用WST-8法檢測活細胞,顯示沒有細胞毒性;脂質體表面SOD的存在由于脂質體的高負電荷,抑制了脂質體的負電荷。然而,凍融脂質體的脂質體攝取低于游離脂質體和脂質體,因為凍融過程后脂質體的表面電荷降低,粒徑越大會減少細胞的攝取。SOD含量高,不能穿透細胞膜。而在靜電排斥力的作用下,脂質體可以有效地將SOD傳遞到膜內。此外,未凍融脂質體與凍融脂質體比,凍融脂質體細胞對凍融脂質體的SOD攝取增加了兩倍。 5細胞內定位 表明脂質體和凍融脂質體都有效地從核內體中逃逸,并且SOD在核內體逃逸后從凍融脂質體中釋放到細胞質中。
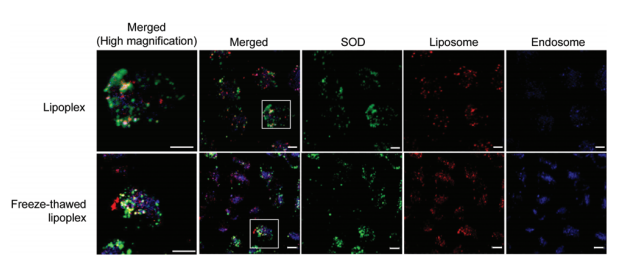
圖5脂質體、超氧化物歧化酶(SOD)和核內體在細胞內的定位。 C26NL17細胞分別與SOD-脂質體和凍融脂質體在37 ℃下孵育24 h。然后固定細胞,用LysoTraccer(藍色)染色,用共聚焦激光掃描顯微鏡觀察(綠色,SOD;紅色,脂質體;藍色,核內體)。實驗重復兩次,每次實驗拍攝3張照片。尺寸:10 μm。合并(高倍放大)顯示放大圖片中的正方形圖片。 6小鼠體內成像
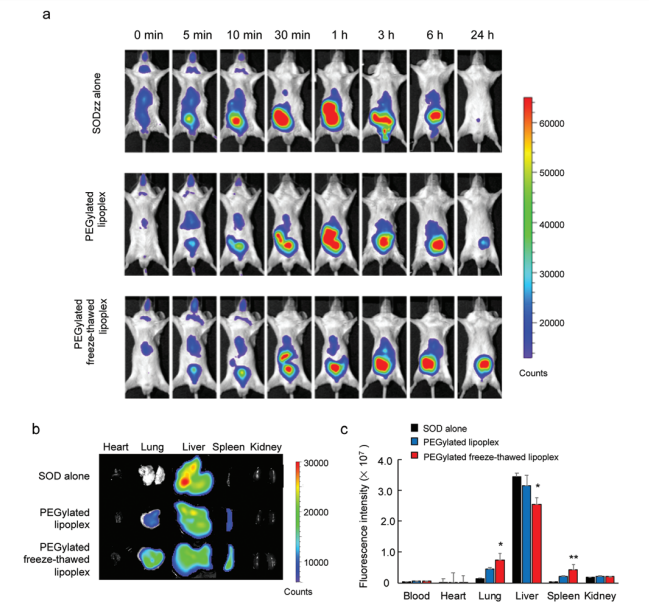
圖6尾靜脈給藥后,Cy5-SOD的體內和體外成像。將聚乙二醇化脂質體(Cy5-SOD劑量,0.2 mg kg 1)經尾靜脈注射到BALB/c小鼠體內。 (a)用體內成像系統(異種原IVIS Lumina系統)觀察Cy5-SOD的實時體內成像。 (b、c)注射24 h后收集心臟、肺、肝、脾、腎等器官,用體內成像系統觀察Cy5-SOD的熒光強度。(b)體外成像和每個器官感興趣的(c)區域。這些數據代表了平均值±標準差(n = 4)).顯著性差異;**p < 0.01,*p < 0.05與。單是SOD。 結論:SOD包裹在凍融脂質體中,阻止其與脂質體分離,顯著改變了其生物分布。這些結果表明,蛋白質封裝是一個有效的體內傳遞.
結論 建立一種利用凍融技術將蛋白質包埋成脂質體的一步法簡便方法。 在這項研究中。采用帶負電荷的SOD和帶正電荷的DCP-deda的脂質體分別作為蛋白質和脂質體模型。SOD-脂質體復合物的SOD在凍融后固定能力增加,這是由于SOD封裝在多層脂質體中的結果。雖然與非凍融脂質體相比,凍融脂質體的細胞對脂質體的攝取減少,但SOD的傳遞量顯著增加,SOD、脂質體和核內體分別定位于細胞內。在小鼠靜脈注射凍融脂質體后,SOD的封裝阻止了其脫離血液中的脂質體,導致游離SOD分布與非凍融脂質體的SOD分布不同。 雖然需要更多的研究優化SOD封裝的數量,闡明釋放凍融脂質體的細胞和多層脂質體結構的形成的機制。目前的方法提供:選擇有用的封裝蛋白質在脂質體,且蛋白質結合不需要有機溶劑或特定的儀器。 |