|
文獻解讀丨肺特異性外泌體用于非小細胞肺癌中miRNA-126的傳遞Use of lung-specific exosomes for miRNA-126 delivery in non-small cell lung cancer 肺特異性外泌體用于非小細胞肺癌中miRNA-126的傳遞
雜志:Nanoscale 影響因子:8.30
摘要: 工程外泌體已成為癌癥治療中流行的藥物傳遞載體。由于外泌體的器官靶向性在全身給藥后的器官分布中起著重要作用,使得外泌體作為藥物載體變得十分有趣。在這里,作者在文章中證明了乳腺癌細胞(MDA-MB-231)來源的外泌體(231-Exo)可以通過外泌體上過表達的整合素β4和癌細胞上的表面活性劑蛋白C (SPC)之間的特定相互作用被非小細胞肺癌細胞特異性內化。 在體外實驗中,231-Exo能夠識別血液中的A549細胞并有效地逃脫免疫監控系統。一旦在外泌體載體中裝載microRNA分子,所產生的裝載有miRNA-126 的工程化外泌體 (miRNA126-231-Exo)便通過中斷PTEN/PI3K/AKT信號通路,強烈抑制A549肺癌細胞的增殖和遷移。靜脈注射載有miRNA-126的外泌體可使小鼠產生有效的肺歸巢效應。當在肺轉移模型中進行測試時,miRNA-231-Exo在體內對肺轉移的形成起到有效的抑制作用。 總之,文章的數據證明了在將外泌體作為藥物載體設計的過程中,利用外泌體的器官靶向性特征的可行性,并在小鼠模型中產生了有效的抗轉移作用。
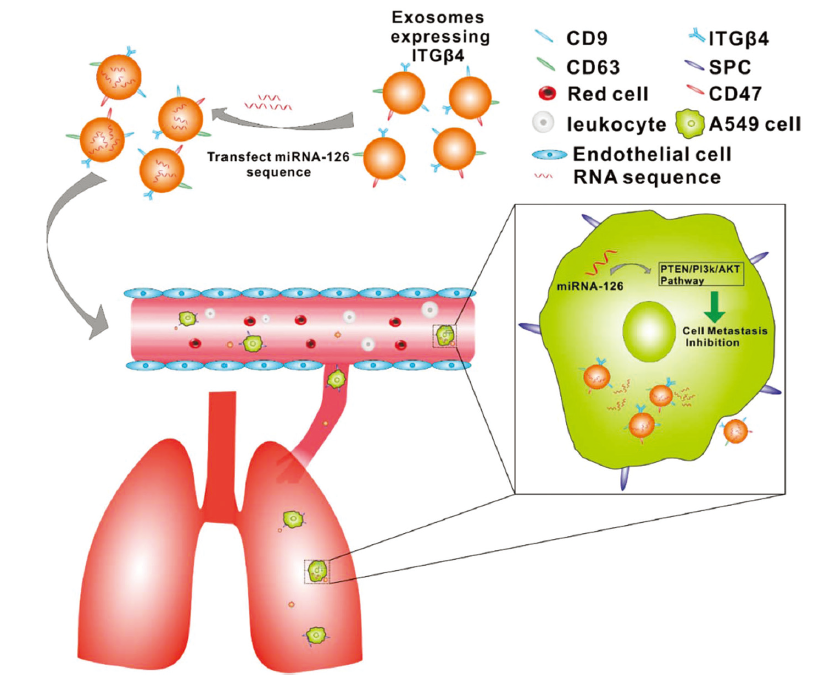
技術示意圖
在非小細胞肺癌中使用載有miRNA-126的外泌體(miRNA-231-Exo)的抗癌機制的示意圖。 外泌體(已經表達ITGβ4表面標記)用于裝載miRNA-126分子。miRNA-231-Exo的器官靶向性特征有助于在肺轉移動物模型中的有效靶向作用。作者認為靶向作用是通過SPC+ A549肺癌細胞(存在于肺和循環中)和ITGβ4+外泌體之間的特異性相互作用介導的。 一旦載有miRNA-126的外泌體被A549細胞內化,便可通過PTEN/PI3K/AKT途徑介導的機制實現抗癌作用。 文章思路 1.外泌體的表征鑒定
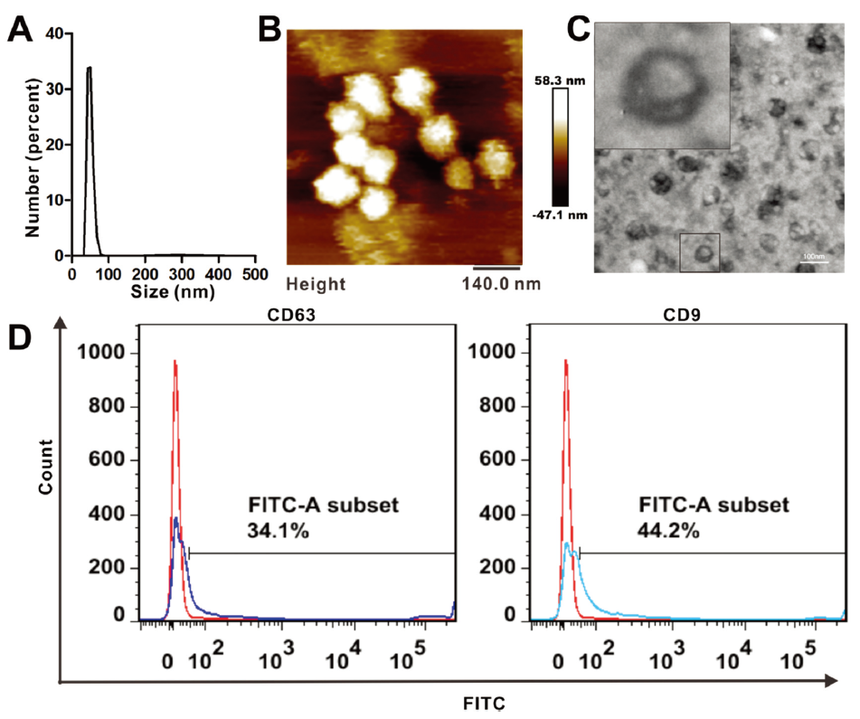
將從MDA-MB-231組織培養物的上清液中分離和純化的乳腺癌來源的外泌體稱之為231-Exo,并對其進行表征鑒定。 首先使用Malvern Zetasizer測定外泌體大小分布,結果表明231-Exo樣品的尺寸范圍為30-120nm(圖A)。同時用AFM和TEM觀察231-Exo樣品的超微結構,觀察到高度均勻的納米球形顆粒(圖B),包括TEM圖片中放大圖片中的脂質雙層結構(圖C)。 在生物學實驗之前,通過BCA對總蛋白的含量進行測定,其濃度為116.3μg /mL,同時在流式細胞術測定中分析231-Exo的CD9和CD63表達,結果發現其表達量分別為34.1%和44.2%(圖D)。初步表明所提取的囊泡狀顆粒為外泌體,并用于后續的實驗進行相關功能的驗證。
2. 體外評估外泌體的癌細胞攝取效率
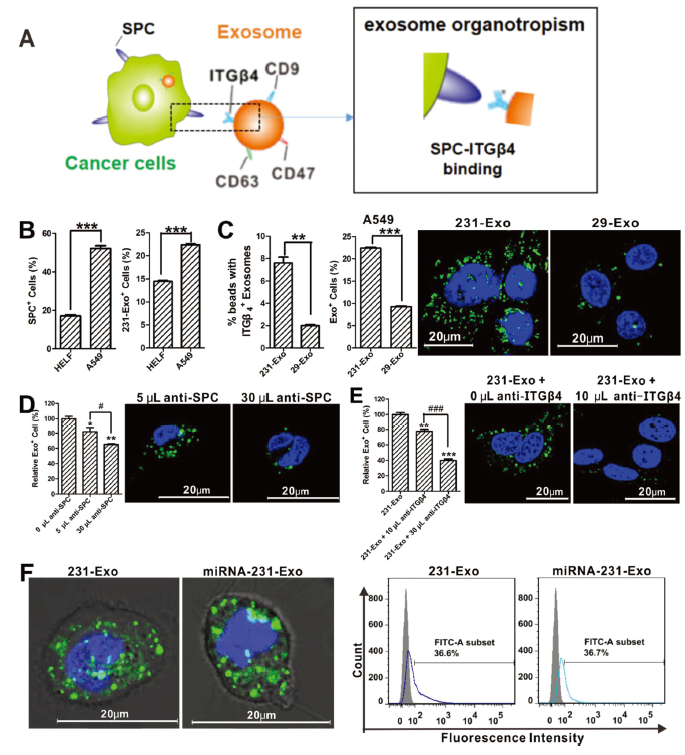
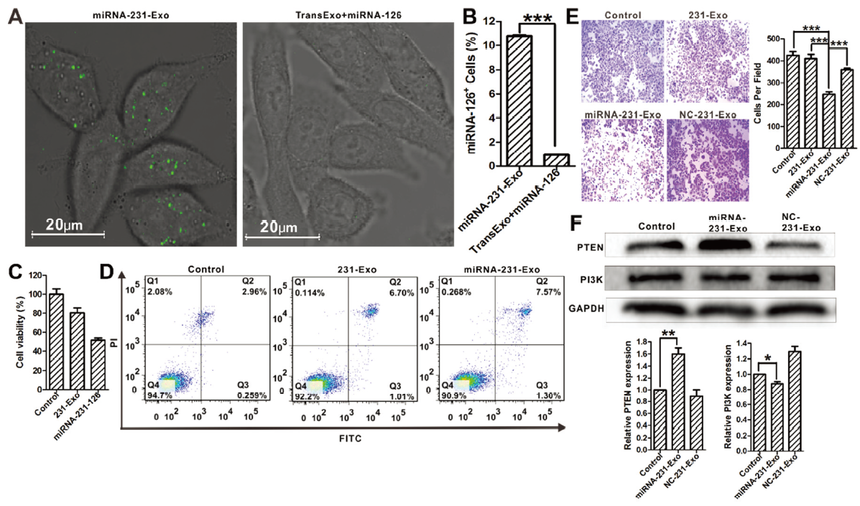
據報道,在231-Exo上的整合素 (ITGβ4)和在肺上皮細胞上的肺泡表面蛋白C(SPC)在兩者特異性結合的過程中中發揮關鍵作用(圖A)。為探究A549細胞中SPC蛋白的表達量,文章采用了流式細胞術分析進行檢測,結果表明:與正常HELF細胞相比,A549細胞中SPC水平高出約3倍(圖B,左圖)。 同時文章中也進行了細胞攝取對比研究,以評估外泌體在A549細胞和HELF細胞中的內化,通過對外泌體進行綠色熒光標記并用流式細胞儀檢測熒光強度,結果表明231-Exo可以在A549細胞中優先被吸收(圖B,右圖)。為了解ITGβ4的作用,文章還引用結腸癌細胞衍生的29-Exo視作對照,經過流式細胞術實驗檢測發現其231-Exo 表面的ITGβ4表達比29-Exo高了4倍左右(圖C,左圖)。 同時文章中也進行了A549細胞對這兩種外泌體的攝取進行了對比,根據流式細胞儀檢測結果可以看出:相比于結腸癌細胞衍生的29-Exo,231-Exo更加容易被A549細胞進行內化,并且ITGβ4與外泌體的吸收呈正相關(圖C,右圖)。 為驗證SPC是否在231-Exo被A549細胞內化的過程中起到作用,文章中使用抗體干擾實驗進行驗證,發現無論是加入抗SPC抗體還是抗ITGβ4抗體,經過流式細胞儀檢測后發現被A549內化的231-Exo均顯著降低,并且這一特性與抗體的體積程正相關(圖D,圖E)。此外,為判斷裝載miRNA后對外泌體231-Exo的影響,利用共聚焦和流式細胞實驗檢測,結果均表明231-Exo在裝載miRNA-231前后變化不大。
3. 外泌體對A549細胞的特異性識別和miRNA-231-Exo在血液中的穩定性
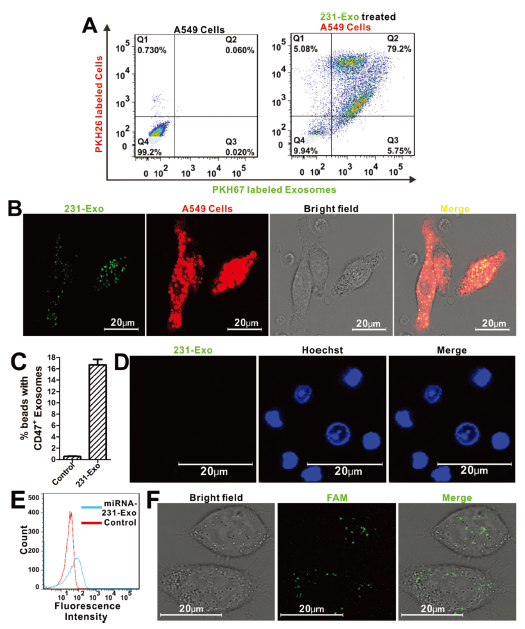
為了模擬231-Exo對A549細胞的特異性識別過程,作者用PKH67對231-Exo進行染色,A549細胞用PKH26進行染色,并將兩者在血液中一起共孵育,采用流式細胞術進行分析,發現有79.2%的A549細胞含有231-Exo(圖A),同時利用,共聚焦顯微鏡也發現了231-Exo(綠色)僅累積到A549細胞(紅色)中,而不是血液中的其他細胞中(圖B)。 此外,為觀察231-Exo是否被免疫系統識別,文章中特意用流式細胞術測定法檢測了231-Exo中的CD47表達,也稱為“不要吃我”信號(有助于在生理條件下維持非惡性細胞的免疫耐受性,但這種分子可以幫助不同癌癥類型的癌細胞存活), 結果表明:231-Exo中的CD47表達量顯著高于對照組(圖C)。為了進一步鞏固數據,利用共聚焦觀察白細胞對231-Exo的攝取,但是實驗結果表明:沒有觀察到明顯的外泌體攝取(圖D)。這意味著231-Exo可以有效地逃離先天免疫細胞。為進一步檢測裝載miRNA的外泌體的穩定性,作者使用流式細胞術(圖E)和共聚焦顯微鏡(圖F)觀察發現在37°C的血液中孵育8小時后,miRNA依舊保持高度完整性,而這促使文章進一步在肺轉移動物模型中測試其抗癌效果。
4. miRNA-231-Exo的體外增殖和遷移抑制作用
為了研究miRNA-231-Exo的遞送效率,將miRNA-126用FAM進行標記,并轉染到231-Exo中,3h后利用共聚焦顯微鏡(A)或流式細胞術(B)觀察miRNA-126-Exo被A549攝取的情況, 結果表明:miRNA-126-Exo能被A549細胞有效吸收。同時文章也檢測了miRNA-231-Exo對A549的細胞毒性, MTT和流式細胞術測定結果表明:A549細胞會受到來源于miRNA-231-Exo的細胞毒性受損,并且空的231-Exo也產生了中等程度的細胞毒性(圖5C和D)。 為了評估miRNA-231-Exo對A549細胞遷移的影響,進行了transwell試驗(圖5E),結果表明:miRNA-231-Exo處理細胞的遷移率低于對照組(圖5E)。為了檢測miRNA-231-Exo在PTEN/PI3K/AKT信號通路上的影響,進行了WB實驗和qPCR實驗以分析以觀察關鍵蛋白因子,WB和qPCR結果表明:miRNA-231-Exo導致PTEN水平增加(圖5F)。 總的來說,231-Exo可以用作天然靶向載體,將miRNA-126遞送至A549細胞,通過PTEN/PI3K/AKT信號通路導致增殖和遷移抑制。
5. miRNA-231-Exo的體內抗轉移作用
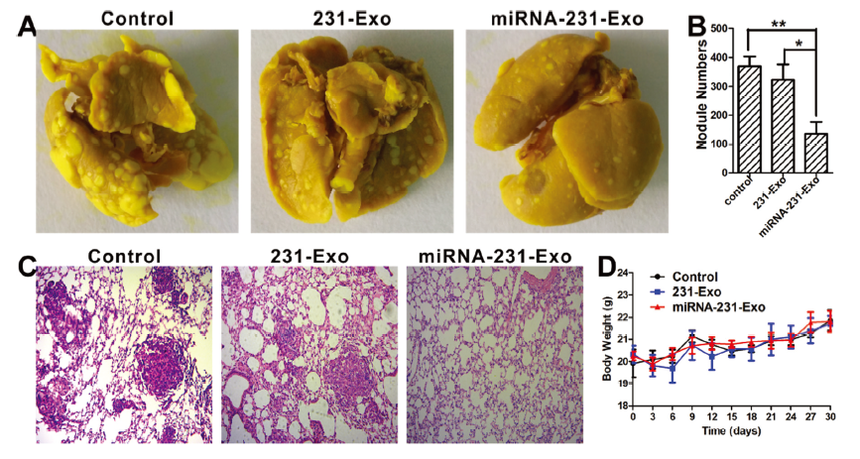
為評估在肺轉移模型中miRNA-231-Exo的體內抗癌治療效果。將A549細胞靜脈注射到裸鼠體內。從第三天起,每3天通過尾靜脈注射miRNA-231-Exo至小鼠體內,共注射7次。 每三天測量一次小鼠的體重。實驗結束時采集動物肺,量化轉移灶數量,結果表明:miRNA-231-Exo治療組有效地減少了肺轉移病變的數量,而免疫組化分析也證實了這一點(圖A-C)。 如圖6D所示,在體重測量上沒有明顯差異。這表明miRNA-231-Exo納米載體具有生物相容性。
結論 文章證明了ITGβ4+乳腺癌細胞衍生的外泌體可以作為天然靶向納米載體用于體外和體內保護性miRNA-126遞送。 這些外泌體被SPC+肺癌細胞大量內化,例如A549細胞。負載miRNA-126的231-Exo通過調控PTEN/PI3K/AKT通路相關因子有效地抑制肺癌細胞增殖和遷移效率。除此之外,載有miRNA-126的231-Exo還可以從先天免疫細胞中有效逃逸,并在在小鼠肺癌轉移模型中顯示出有效的癌癥抑制效率。 文章中的數據證明促使作者評估外泌體 “器官效應”的貢獻,這是一個可能影響癌癥治療效果的關鍵特征。 |